Специфическая профилактика инфекционных болезней — стратегическая задача ветеринарной службы в свиноводстве. Недавний мониторинг ситуации в России показал, что одни из наиболее распространенных возбудителей в свиноводческих хозяйствах этой страны — цирковирус свиней 2-го типа (ЦВС-2), Mycoplasma hyopneumoniae и возбудитель илеита Lawsonia intracellularis, к которым серопозитивны 100, 60 и 86,5 % хозяйств соответственно. Все три возбудителя эндемичны для всех стран с промышленным свиноводством. ЦВС-2 и M. hyopneumoniae — первичные респираторные патогены, которые вместе с вирусом РРСС являются основными возбудителями комплекса респираторных болезней свиней (КРБС).
Вакцинация — основное средство контроля и профилактики этих заболеваний во всем мире. Уровень вакцинации национального поголовья против ЦВС-2 в 2009 году в США составил более 95 %, в Канаде и Мексике — более 80 %, в Великобритании и Южной Корее — более 70 %, в Японии и Германии — более 65 %. Вакцинация поросят против энзоотической пневмонии (M. hyopneumoniae) давно стала рутинной мерой в странах с индустриальным свиноводством. Кроме того, широко практикуется вакцинация против болезни Ауески, актинобациллезной плевропневмонии (АПП) и болезни Глессера, возбудители которых также являются составными частями КРБС.
Общие вопросы
Довольно часто у практикующих ветеринарных врачей возникают вопросы: «Как правильно интерпретировать результаты лабораторных исследований на РРСС, ЦВС-2, M. hyopneumoniae, АПП, болезнь Глессера, Ауески?», «По каким параметрам лучше оценивать эффективность вакцин против респираторных болезней свиней?». Учитывая большую актуальность и практическую значимость этих вопросов, в данной статье мы рассматриваем основные методы оценки эффективности вакцинации против респираторных болезней свиней в практических условиях.
Профилактика болезней поросят и свиней
Заметить симптомы болезней свиней несложно, если регулярно проводить осмотры. Профилактическими мероприятиями по предотвращению недугов:
- санобработка помещений;
- иммунизация поголовья вакциной;
- контроль за условиями содержания;
- правильная утилизация отходов фермы, бойни;
- борьба с грызунами, паразитами;
- безвыгульное содержание;
- регулярная дезинфекция помещений.
Премиксы
Чтобы вырастить здоровое поголовье, стоит уделить должное внимание питанию свиней. Для укрепления иммунитета необходимо обеспечить организм необходимыми веществами, минералами, витаминами. Чтобы это было возможно при безвыгульном содержании и в любое время года, необходимо применять комплексные добавки.
предлагает премиксы для свинок. Они являются добавкой к основному рациону, которую подмешивают к основной пище. Благодаря наличию в составе минералов, витаминов, ферментов, биодобавок иммунитет поросят, свиней укрепляется.
Витацид
Одним из необходимых продуктов при ведении хозяйства, считается «Витацид». Купить сухой подкислитель кормов можете со склада нашей компании. В препарате сочетаются органические кислоты, соли. Достоинством продукта считается высокая противомикробная активность.
Этот подкислитель активен против ряда микроорганизмов:
- грибы;
- бактерии;
- дрожжи;
- сальмонеллы;
- клостридии.
Пробиотик «Симбитокс»
Мы рассмотрели, какие болезни у поросят часто встречаются в животноводческой практике. Чтобы предотвратить убытки на ферме, стоит позаботиться об укреплении иммунитета поголовья. Также стоит обзавестись средствами для выведения токсинов из организма. Весьма эффективным считается комплексный сорбент «Симбитокс». Его применяют с целью профилактики отравлений разной этиологии.
Выращивайте здоровое поголовье с продукцией . Предлагаем фермам по доступной цене комбикорма, премиксы, пробиотики. Цена товара зависит от вида, объема.
Лабораторные исследования
Самый распространенный метод лабораторных исследований — серологические исследования. В целом исследование сывороток крови на наличие антител позволяет:
- выяснить статус стада (есть/нет циркуляция возбудителя);
- определить уровень серопревалентности в группе/стаде (не для всех болезней);
- установить длительность колострального иммунитета;
- определить динамику заболевания в стаде (не для всех болезней);
- провести дифференциацию переболевших и вакцинированных или неинфицированных животных (болезнь Ауески — антитела к белкам gB и gE, АПП — антитела к токсину ApхIV, болезнь Глессера — антитела к белку OppA и др.).
Для выявления болезни Глессера (гемофилезный полисерозит) сейчас доступны исследования как на общие антитела (например, в наборе ИФА Biovet, Канада), так и на антитела к белку OppA (набор ИФА BioChek, Нидерланды), которые образуются только в организме переболевших свиней (отсутствуют у здоровых носителей возбудителя). В OppA-тесте могут позитивно реагировать также привитые животные. Для исследований стада на наличие циркуляции возбудителя АПП любого серотипа целесообразнее всего использовать наборы, выявляющие антитела к токсину ApxIV, которые образуются только в организме свиней, контактировавших с полевым возбудителем АПП (любого серотипа). После вакцинации против АПП любой вакциной антитела к токсину ApxIV не образуются, поскольку он не входит в состав вакцин.
С учетом того, что хронические формы АПП, болезни Глессера и стрептококкоза имеют очень сходные поражения, использование вышеописанных тестов — хороший диагностический инструмент.
Таким образом, информативность/ценность результатов зависит от выбора диагностического набора, квалификации лаборатории, выявляемых антител (IgG, IgM, белки, токсины и др.), схемы пробоотбора и других факторов.
Диагностика и профилактика бактериальных инфекций свиней с респираторным синдромом
Русалеев В. С. профессор, заведующий лаборатории, Бирюченков Д. А., ветеринарный врач, Фроловцева А. А. ветеринарный врач, ФГУ ВНИИЗЖ. Респираторные инфекции у свиней являются одной из наиболее актуальных проблем ветеринарии. Возбудителями данной группы болезней являются бактерии, вирусы и микоплазмы. К числу 14 наиболее распространенных инфекционных болезней свиней, на которые по данным Департамента ветеринарии приходится около 95% заболевших и 94% павших свиней в РФ, из бактериальных инфекций относятся пастереллез, гемофилезный полисерозит и актинобациллезная плевропневмония.
Эти заболевания вызывают бактерии, относящиеся к семейству Pasterellaceae: Pasteurella multocida, Haemophilus parasuis и Actinobacillus pleuropneumoniae.
Бактерии вида P. multocida являются возбудителями геморрагической септицемии, легочных пастереллезов и атрофического ринита. Pasteurella multocida подразделяется на 5 серогрупп по капсульному антигену (A, B, D, E, F) и 16 серотипов по соматическому антигену.
Геморрагическая септицемия — это контагиозное инфекционное заболевание животных, характеризующееся явлениями септицемии с множественными кровоизлияниями. У свиней встречается очень и очень редко. Возможно из-за вакцинации, так как во всех противопастереллезных вакцинах в Российской Федерации имеется антиген против геморрагической септицемии. За 14-летний период работы по изучению пастереллеза в ФГУ ВНИИЗЖ сотрудникам лаборатории микробиологии только один раз удалось столкнуться с данной формой пастереллеза. Геморрагическую септицемию у свиней вызывает Pasteurella multocida серовар B:2.
(У крупного рогатого скота и буйволов это более распространенное заболевание.)
Легочной пастереллез (основная форма пастереллеза встречающаяся у свиней в РФ) — это инфекционное заболевание, характеризующееся признаками воспаления легких. Вызывается Pasteurella multocida сероварами А:3, А:1 реже А:12 и очень редко А:4.
Эпизоотологические данные — к пастереллезу восприимчивы животные всех возрастов, но наиболее чувствителен молодняк. Заболевание регистрируется в течение года с определенным подъемом в осеннее — зимний период. Заражение происходит аэрогенно и алиментарным путем, а также при прямом контакте.
Механизм развития инфекционного процесса определяется сероваром возбудителя. Пастереллы серогруппы В размножаются в месте первичного внедрения в макроорганизм, далее попадают в лимфатическую систему и кровь, вызывая септицемию.
Пастереллы серогруппы А проникают в легкие, где размножаются, продукты их жизнедеятельности разрушают стенки кровеносных сосудов, вызывая вначале гиперемию и отек, затем крупозное воспаление легких.
Никаких специфических признаков, указывающих на пастереллезную этиологию болезни нет.
При геморрагической септицемии наблюдают симптомы сепсиса: повышение температуры тела, мышечную дрожь, угнетение, напряженное дыхание (иногда отеки в подчелюстной области). Животные погибают при явлениях асфиксии в течение 1 — 2 суток.
При легочном пастереллезе наблюдают: повышение температуры тела, угнетение, потерю аппетита, серозное истечение из носа (иногда слизистое). В дальнейшем появляется отдышка и кашель.
Патологоанатомические изменения.
При геморрагической септицемии — кровоизлияния под серозными покровами и в слизистых оболочках: гортани, трахее, плевре, под эпикардом и эндокардом.
Легкие отечны и гиперемированы. Возможны отеки в области головы, подчелюстной области.
При легочном пастереллезе — пораженные участки легких красного цвета, уплотнены, легко разрываются при надавливании. Отдельные участки некротизированны и инкапсулированы. Возможен серозно — фибринозный плеврит и перикардит. Бронхиальные и средостенные лимфоузлы увеличены, рыхлые с кровоизлияниями.
Диагноз ставят на основании выделения и идентификации культуры возбудителя.
Необходимо отметить, что из-за несовершенства лабораторной диагностики пастереллеза в РФ, ветеринарные врачи не знают пастереллы каких серогрупп и сероваров циркулируют в том или ином регионе страны, и соответственно с каким пастереллезом в каждом конкретном случае приходится иметь дело. Диагноз на пастереллез по наличию специфических антител в сыворотке крови животных не ставится. Присутствие антител в крови указывает лишь на контакт животного с соответствующим микроорганизмом.
Профилактика и меры борьбы.
Иммунитет у свиней при заболеваниях, вызываемых бактериями семейства Pasterellaceae обусловлен гуморальными и клеточными факторами. Оценить концентрацию или определить титр антител, например, противопастереллезных не трудно при помощи многих серологических реакций (РА, ИФА и др.), но интерпритировать полученные результаты достаточно сложно. Параллелизма между уровнем антител и степенью защищенности животного нет.
Если на ферме зарегистрировано заболевание свиней пастереллезом то всех животных необходимо вакцинировать против него в течение года. Такие хозяйства должны комплектоваться только вакцинированными свиньями.
Для специфической профилактики пастереллеза животных в РФ используют инактивированные вакцины (сорбированные и эмульсионные). Для свиней лучше подходят эмульсионные препараты, так как они обеспечивают более напряженный и продолжительный иммунитет.
Основным недостатком эмульсионных вакцин является то, что масляный адъювант, входящий в их состав не метаболизируется в организме животных. Выбирая вакцину, ветеринарный врач не должен забывать об основном критерии, которому она должна удовлетворять — специфическая эффективность. Для оценки эффективности вакцинации животных против пастереллеза (гемофилезного полисерозита, и ряда других бактериальных инфекций) титры антител не используют. Об эффективности вакцинации против пастереллеза и пастереллоподобных заболеваний судят по снижению уровня заболеваемости и падежа среди иммунизированных животных.
Успех вакцинопрофилактики пастереллеза определяется обоснованным выбором препарата. Большинство противопастереллезных вакцин производимых в РФ изготавливаются из одного или нескольких штаммов Pasteurella multocida, относящихся как правило к серогруппе В. Эти вакцины обеспечивают неплохую защиту против геморрагической септицемии, но не против легочного пастереллеза.
Наблюдаемая порой невысокая эффективность некоторых противопастереллезных вакцин обусловлена как правило несоответствием серовариантного состава штаммов пастерелл, используемых для изготовления вакцины и вызывающих заболевание у свиней. (Перекрестного иммунитета при иммунизации и последующем заражении пастереллами разных сероваров нет).
Начиная вакцинацию необходимо точно знать против какого или каких сероваров ее проводить. В выбираемой вакцине должны присутствовать антигены против этих сероваров. Т. е. серовар антигена в вакцине должен соответствовать серовару Pasteurella multocida вызвавшему заболевание.
При возникновении пастереллеза (геморрагической септицемии) среди свиней в хозяйстве вводят ограничения. Все поголовье обследуется клинически, условно здоровых вакцинируют (можно вначале пассивно иммунизировать с помощью гипериммунной сыворотки против пастереллеза крупного рогатого скота, буйволов, овец и свиней, а через 2 недели вакцинируют).
Больных и подозрительных лечат, определив предварительно чувствительность выделенных культур Pasteurella multocida к антибактериальным препаратам. С лечебной целью при остро протекающем пастереллезе в начале заболевания с успехом можно использовать гипериммунную сыворотку (внутримышечно или внутривенно в двойной профилактической дозе).
Атрофический ринит — инфекционное контагиозное заболевание, вызываемое Pasteurella multocida серогруппы Д и Bordetella bronchiseptica. Наиболее яркая и характерная клиника — это искривление верхней челюсти свиней за счет расплавления носовой перегородки, вызываемой продуктами жизнедеятельности токсигенных штаммов Pasteurella multocida. В начале заболевания отмечается чихание, чесание носа и т. д. Заболевание на территории нашей страны широко регистрировалось в начале 60-х годов. Сейчас — буквально единичные случаи. На западе ему уделяют большое внимание. В противопастереллезные вакцины, выпускаемые ФГУ ВНИИЗЖ, обязательно закладывается антиген Pasteurella multocida серогруппы Д.
Гемофилезный полисерозит — инфекционное септическое заболевание, характеризующееся серозно-фибринозным воспалением перикарда, плевры, брюшины, суставов.
Возбудитель болезни — Haemophilus parasuis неоднородная в антигенном отношении, мелкая грамотрицательная, капсулообразующая неподвижная, не образующая спор, полиморфная палочка, обладающая резко выраженным тропизмом к серозным оболочкам. Нуждается в V факторе роста.
Различают 5 серогрупп (A, B, C, D, N) по капсульному и 15 сероваров по соматическому антигену. Согласно литературных данных самыми вирулентными и распространенными в Европе и Северной Америке являются серовары №№ 2, 4, 5, которые обязательно включают в состав инактивированных вакцин. Штаммовый состав вакцин иногда дополняют сероварами № 12, 13, 14.
Эпизоотологические данные.
В неблагополучных по гемофилезному полисерозиту хозяйствах до 40% свинопоголовья являются носителями возбудителя болезни (свиноматки, ремонтные свинки).
Заболеваемость поросят полисерозитом достигает 20-25%, а смертность — 10% восприимчивого поголовья.
Поросята заболевают обычно через 8-15 дней после отъема от свиноматок.
Чаще гемофилезный полисерозит регистрируется среди поросят, подвергшихся воздействию неблагоприятных факторов внешней среды (отъем от свиноматок в раннем возрасте, перегруппировки, содержание в группах свиней разного возраста, неудовлетворительный микроклимат в помещениях, высокая запыленность воздуха, транспортировка, переохлаждение, перегревание и др.).
Клинические признаки — повышение температуры тела до 40,5 — 41,50С. Симптомокомплекс плеврита, перитонита, перикардита часто в сочетании с артритами. Животные угнетены, поросята осторожно передвигаются (залеживание), шерсть взъерошенная, дыхание затрудненное, учащенное, время от времени можно услышать кашель. Иногда отеки в области ног, ушей, рыла, брюшной стенки. У некоторых животных кровоизлияния на коже.
Через 2-5 дней поросята погибают с симптомами сердечной слабости, синюшности кожных покровов подчревной области и конечностей. Гемофилезным полисерозитом болеют всегда только несколько поросят из помета или группы.
Патологоанатомические изменения — серозно-фибринозное воспаление плевры, брюшины, перикарда, кровоизлияния на печени, почках. В плевральной, брюшной полостях, сердечной сумке значительное количество эксудата соломенно-желтого цвета с нитями фибрина.
Предварительный диагноз можно поставить на основании характерной патологоанатомической картины при вскрытии, а окончательный на основании выделения и идентификации культуры возбудителя болезни.
Профилактика. Основное звено в системе мер борьбы и профилактики гемофилезного полисерозита это вакцинация, которая обеспечивает снижение заболеваемости и падежа поросят.
Сроки вакцинации зависят от возраста поросят среди которых появляются клинические признаки болезни. Если гемофилезный полисерозит поражает свиней в период после отъема и доращивания, то вакцинировать животных необходимо в возрасте 3-4 недели. Если болезнь поражает поросят в раннем возрасте, то необходима вакцинация свиноматок.
У ряда животных после введения вакцины возможны анафилактические реакции. В этом случае применяют антигистаминные препараты. Большое антигенное разнообразие возбудителя и трудности его культивирования делают противогемофилезные вакцины довольно дорогими.
Сотрудниками ФГУ ВНИИЗЖ разработана ассоциированная вакцина против сальмонеллеза, пастереллеза и гемофилезного полисерозита свиней, которая неплохо себя зарекомендовала в хозяйствах.
Лечение.
Эффективно лишь на ранних стадиях развития болезни. При появлении клинических признаков лечение малоэффективно. Если поросята остаются живыми, то они часто отстают в росте.
Важно, чтобы лечению при появлении первых клинических признаков подвергались все животные помета или группы.
Актинобациллезная плевропневмония свиней — инфекционное контагиозное заболевание свиней, характеризующееся геморрагической некротизирующей пневмонией и фибринозным плевритом. К инфекции наиболее чувствителен молодняк 2-4 месячного возраста.
Заболевание широко распространено в странах с развитым свиноводством и наносит значительный экономический ущерб. В Российской Федерации болезнь впервые была диагностирована в 1975 году М. А. Сидоровым и Д. И. Скородумовым.
Возбудителем болезни является грамотрицательная бактерия Actinobacillus pleuropneumoniae. Возбудитель более месяца сохраняется в эпителии дыхательных путей, ткани легких и в миндалинах переболевших животных, которые представляют опасность для здоровых свиней. Передача инфекции осуществляется в основном воздушно-капельным путем.
Из-за скудности информации в отечественной печати об этой инфекции практические ветеринарные специалисты мало знакомы с актинобациллезной плевропневмонией свиней. Поэтому знакомство ветеринарных специалистов с некоторыми клиническими и патологоанатомическими признаками заболевания и основными элементами профилактики вполне обосновано.
Актинобациллезная плевропневмония протекает у свиней сверхостро, остро и хронически.
При сверхостром течении у животных повышается температура тела до 42º С. Поросята угнетены, дыхание затруднено, возможна рвота, сине-красное окрашивание кожи ушей, пятачка и живота. В агональной стадии отмечается истечение из носовых отверстий кровянистой жидкости. Смерть наступает в течение 6-24 часов после появления первых клинических признаков болезни.
При острой форме болезни у свиней наблюдают повышение температуры до 41ºС, одышку, кашель, пенистые истечения из носа. Животные погибают в течение 2-5 суток.
Хроническое течение инфекции проявляется в виде кратковременного повышения температуры, кашля, учащенного дыхания, бледности кожных покровов, поражения суставов, отставания в росте и развитии.
При вскрытии трупов наблюдают геморрагическое воспаление легких с выраженным отеком интерстициальной соединительной ткани. Пораженные участки легких плотные, вишнево-красного цвета, выступают над поверхностью окружающей нормальной ткани, при надавливании с поверхности разреза стекает кровянистая жидкость. Возможны — фибринозный плеврит и перикардит, а также скопление кровянистой жидкости в грудной полости.
При хроническом течении у большинства трупов находят инкапсулированные очаги некроза в легких и значительное увеличение тканей вокруг пораженных суставов.
При неожиданном появлении в стаде поросят с респираторным синдромом необходимо срочно направить материал для исследования в лабораторию.
Выделение возбудителя из патологического материала, его идентификация в совокупности с положительными результатами заражения лабораторных животных будет являться прямым доказательством роли выделенного микроорганизма в возникновении болезни.
При установлении диагноза в хозяйстве проводят следующие мероприятия:
— ограничивают насколько это возможно, перемещение животных и персонала;
— проводят дезинфекцию свинарников, соблюдая принцип «Все занято — все пусто»;
— больных и подозреваемых в заболевании удаляют из стада и лечат, используя антибиотики, сульфаниламиды и другие препараты, предварительно определив чувствительность выделенного возбудителя к антибактериальным препаратам;
— всех здоровых животных вакцинируют.
Иммунопрофилактика актинобациллезной плевропневмонии осуществляется различными вакцинами по разным схемам.
В неблагополучных по плевропневмонии свиноводческих хозяйствах высокий профилактический результат удается получить, вакцинируя как маточное поголовье, так и молодняк. Иммунизация только поросят обычно не дает положительного результата. Вакцинация свиноматок обеспечивает защиту новорожденных за счет колостральных антител до 4 недельного возраста, а последующая иммунизация поросят позволяет создать относительно ровный иммунный статус молодняка в стаде.
Для борьбы с вышеизложенными инфекциями обычно используют антибиотики. Однако они стоят дорого и не всегда эффективны. Кроме того, возникают проблемы связанные, во-первых, со все увеличивающейся резистентностью микроорганизмов к антибиотикам и, во-вторых, в связи с остатками антибиотиков в продукции животноводства, предназначенной для человека.
Таким образом, одним из основных приемов, в системе мер профилактики и борьбы с бактериальными инфекциями свиней с респираторным синдромом является вакцинация животных на фоне повышения общей санитарной культуры ведения животноводства.
Необходимо также отметить, что для того чтобы вакцины против пастереллеза, гемофилезного полисерозита и актинобациллезной плевропневмонии были высокоэффективны, следует учитывать эпизоотическую ситуацию в хозяйстве и характеристику вакцины, то есть в состав вакцины должны входить соответствующие сероварианты этих возбудителей.
Цирковирусная инфекция свиней
Много дискуссий вызывает вопрос значимости серологических исследований для оценки эффективности вакцин/вакцинации против ЦВС-2. Он напрямую взаимосвязан со следующими ключевыми вопросами.
- Все ли стада серопозитивны?
- Образуются ли антитела после переболевания?
- Образуются ли антитела после вакцинации?
- Можно ли серологически отличить привитых и переболевших животных?
- Можно ли оценить уровень клеточного иммунитета к ЦВС-2 путем исследований сывороток крови на антитела?
- Есть ли зависимость между уровнем антител к ЦВС-2 и защитой от заболевания?
Общеизвестно, что во всем мире все коммерческие стада (хозяйства), включая SPF, позитивны по ЦВС-2. То есть во всех хозяйствах у свиней есть носительство этого вируса. Основываясь на данных литературы и собственных исследованиях, на первые три вопроса можно однозначно ответить «да». К сожалению, на вторые три вопроса ответ будет «нет».
Для серологической диагностики ЦВС-2 в России сейчас доступны несколько коммерческих наборов ИФА, а также исследования ФГБУ «ВНИИЗЖ» («домашняя ИФА», т. е. реакция ставится с использованием коммерческих и собственных реагентов, включая антиген).
Коммерческие тест-системы ИФА:
- набор компании Synbiotics (США);
- набор компании BioChek (Нидерланды);
- набор компании Ingenasa (Испания);
- набор (РФ).
Одни из главных характеристик, определяющих конечный результат исследований, — чувствительность и специфичность теста.
Наибольшей чувствительностью, т. е. способностью определять потенциально/истинно позитивные пробы, обладают наборы ИФА компаний Synbiotics и BioChek.
Набор компании Ingenasa — Ingezim Circovirus IgG/IgM — обладает меньшей чувствительностью. Однако он ценен тем, что это единственный набор, позволяющий дифференцировать ранние антитела IgM (образуются большей частью после контакта с живым вирусом) от антител IgG (образуются спустя две-три недели после контакта с полевым или вакцинным антигеном). Этот набор позволяет определить статус цирковирусной инфекции в стаде: «активная инфекция», «заболевание было недавно», «животные переболели давно или не имели активной инфекции».
При разработке серологического теста ИФА, используемого для исследования полевых сывороток крови в ФГБУ «ВНИИЗЖ», эталоном являлся коммерческий набор ИФА Ingezim Circovirus IgG/IgM (Ingenasa, Испания). По официальным данным разработчиков, чувствительность российского теста относительно коммерческого набора ИФА Ingezim составила 67 %. Однако эта система не позволяет отдельно исследовать IgM и IgG, как оригинальный тест.
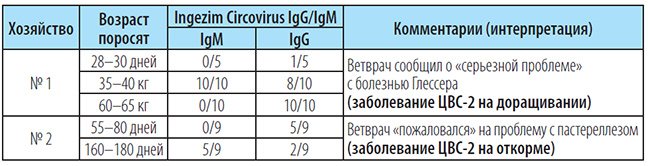
В табл. 1 представлены два реальных примера значимости серологических исследований на ЦВС-2.
Таблица 1. Результаты исследования сывороток крови свиней из хозяйств, не вакцинирующих от ЦВС-2
Положительных проб/исследовано проб всего.
В данных исследованиях важным диагностическим показателем стало наличие иммуноглобулинов класса M (IgM), которые появляются в первые дни после инфицирования полевым возбудителем. Врачи вышеуказанных хозяйств, опираясь на клиническую картину, результаты патологоанатомического вскрытия и неполных лабораторных исследований (обнаружение Haemophilus parasuis и Pasteurella multocida в пробах патматериала от больных животных), даже не подозревали о наличии цирковирусной инфекции и первичной роли ЦВС-2 в наблюдаемых симптомокомплексах.
Нами также были проведены сравнительные серологические исследования сывороток крови привитых против ЦВС-2 свиней из десяти российских хозяйств в двух коммерческих тестах (табл. 2).
Таблица 2. Результаты исследований в ИФА сывороток крови свиней групп доращивания и откорма, привитых против ЦВС-2
Положительных проб/исследовано проб всего.
Как видно из табл. 2, все вакцины стимулируют выработку гуморальных антител (IgG). Уровень серопревалентности (количество позитивных проб) больше зависит от характеристик выбранного теста, чем от вакцины. Вакцины, изготовленные на основе масляных адъювантов, как правило, дают более высокие титры антител. Это также справедливо в отношении двухдозовых вакцин. Важный диагностический показатель — наличие иммуноглобулинов IgM, которые могут показывать наличие активной или субклинической инфекции среди вакцинированных животных.
В то же время необходимо помнить, что серологические исследования на ЦВС-2 не являются ведущим критерием оценки эффективности вакцин/вакцинации против этого заболевания.
Серологические исследования на ЦВС-2 актуальны для оценки динамики заболевания в стаде (показывают время инфицирования/контакта животных с полевым вирусом). Все вышеуказанные тест-системы пригодны для такого исследования, но нужно учесть, что уровень сероконверсии (количество позитивных проб), уровень антител и время их выявления будут сильно различаться в зависимости от использованного диагностического набора.
Многочисленными исследованиями в Северной Америке и Европе установлено, что уровень антител к ЦВС-2 не коррелирует с защитой от заболевания. Уровень гуморальных антител (IgG) в крови индивидуален для каждого животного и не является достоверным показателем его защиты или заболевания ЦВС-2. Антитела свидетельствуют лишь о контакте иммунной системы животного с антигеном ЦВС-2 любого происхождения, но не информируют о последствиях.
В табл. 3–5 представлены результаты независимого канадского исследования, направленного на изучение связи серологического ответа и времени вакцинации с уровнем защиты поросят от ЦВС-2. В данном исследовании поросят в возрасте 19–59 дней прививали вакциной Ингельвак ЦиркоФЛЕКС. До опыта в хозяйстве клинические признаки цирковирусной инфекции обычно начинали проявляться в возрасте около 85 дней.
Таблица 3. Средний уровень антител (IgG) к ЦВС-2 в ИФА у контрольных и вакцинированных поросят, привитых в возрасте 26, 40 и 52 дней
* Положительная сыворотка при значении s/p ≥ 0,3.
** Один день после вакцинации.
Таблица 4. Средний геометрический титр антител к ЦВС-2 в НРИФ у контрольных и вакцинированных поросят, привитых в возрасте 26, 40 и 52 дней
* СГТА — средний геометрический титр антител; НРИФ — непрямая реакция иммунофлюоресценции.
** Один день после вакцинации.
Таблица 5. Смертность среди контрольных и вакцинированных поросят на откорме
По результатам данного исследования можно сделать два основных вывода.
Первый: не обнаружено корреляции между уровнем антител после вакцинации и последующей защитой поросят от ЦВИС. Независимо от того, что сероконверсия после вакцинации была слабой или совсем отсутствовала, все группы вакцинированных поросят были хорошо защищены от заболевания.
Самая младшая протестированная группа — это поросята, вакцинированные в 26-дневном возрасте. Несмотря на то что к 30-му дню после вакцинации ни у одного из протестированных поросят не наблюдалась сероконверсия, уровень защиты был достаточно высоким (уровень падежа в вакцинированной группе составлял 2,8 % против 10,6 % в контрольной группе).
Второй: поросят можно эффективно вакцинировать в присутствии материнских антител. Поросята, которым на момент вакцинации исполнилось от 19 до 22 дней, были самыми младшими среди вакцинированных и имели самый высокий уровень материнских антител. Несмотря на это, уровень падежа в данной группе оказался в 19 раз ниже, чем в непривитой контрольной (0,4 % против 7,6 %).
Последний вывод также был подтвержден исследованиями в Западной Европе, где не наблюдали никакой разницы между группами привитых поросят с высокими и низкими титрами колостральных антител (см. Табл. 6).
Таблица 6. Общий привес (кг) у вакцинированных поросят с высокими или низкими титрами материнских антител на момент вакцинации
Поросята вакцинированы Ингельвак ЦиркоФЛЕКС в возрасте 2–4 недель жизни.
При проведении данного исследования установлено, что титры антител >1:320 у поросят перед вакцинацией не оказывали отрицательного влияния на эффективность вакцины. Все вакцинированные животные, независимо от уровня материнских антител, имели значительно больший привес, чем контрольные непривитые животные. Это подтверждает результаты предыдущих работ, в которых было продемонстрировано отсутствие интерференции с материнскими антителами, когда поросят иммунизировали вакциной Ингельвак ЦиркоФЛЕКС в период отъема.
Поэтому можно утверждать, что вакцина эффективно преодолевает высокий уровень материнских антител начиная с возраста 2 недель и старше.
Сейчас во всем мире для оценки качества вакцин/вакцинации против ЦВС-2 ориентируются на следующие показатели:
- наличие/отсутствие виремии и ее уровень у привитых животных (исследование проб крови/сывороток крови в ПЦР в реальном времени на наличие вируса и его количества). Установлено, что уровень ЦВС-2 в крови, эквивалентный ≥5–6 lg копий ДНК/мл сыворотки, коррелирует с клиническими формами заболевания. В России количественная ПЦР (ПЦР в реальном времени) для исследования на ЦВС-2 разработана в ФГУ «ВНИИЗЖ», а также в ряде других научных учреждений. В последнее время в нашей стране стали доступны коммерческие ПЦР-наборы (например, LSI VetMAX Porcine Circovirus 2, Франция), которые могут использоваться в лабораториях с необходимым уровнем оборудования и квалификации персонала;
- сравнение производственных параметров у привитых и невакцинированных животных / до и после вакцинации / привитых разными вакцинами (заболеваемость, смертность, уровень выбраковки, среднесуточный привес, однородность животных, конверсия корма и др.).
Сравнение производственных показателей, безусловно, основной критерий полевой эффективности для вакцин против всех респираторных заболеваний.
Together beyond animal health
Характеристика болезни
Актинобациллезная (актинобациллярная, гемофилезная) плевропневмония свиней – инфекционная болезнь, характеризующаяся развитием пневмонии и плеврита преимущественно в каудо-дорсальных областях легких. Термин «гемофилезная плевропневмония» применялся ранее и в настоящее время устарел, поскольку возбудитель в 1983 году был перемещен из рода Haemophilus в род Actinobacillus.
Болезнь наносит огромный экономический ущерб свиноводству, который складывается из:
А) «явного» — при клиническом проявлении (выбраковка, падеж, затраты на лечение)
Б) «скрытого» — при субклиническом (ухудшение конверсии кормов, снижения привесов, увеличения периода откорма, выбраковки на убое и т.п)
Возбудитель
— микроорганизм Actinobacillus pleuropneumoniae (ранее Haemophilus pleuropneumoniae, H. parahaemolyticus) – грамотрицательная капсулообразующая плеоморфная палочка.
На сегодняшний день известно 2 биовара (подтипа) A. pleuropneumoniae, которые включают 15 серотипов микроорганизма. Все эти серотипы подразделяются на: высоко-, средне- и низковирулентные (Таблица 1).
Таблица 1. Краткие характеристики различных серотипов A.pleuropneumoniae
Серологическая специфичность данного микроорганизма и разделение на серотипы обусловлены различиями в строении капсульных полисахаридов и клеточных липополисахаридов (англ. lipopolysaccharides (LPS)). В связи с тем, что некоторые серотипы имеют похожую структуру длинноцепочечных OLPS, наблюдаются перекрестные реакции и трудности серологической дифференциации между некоторыми из серотипов (например, серотипы: 1-9-11, 3-6-8, 4-7).
Патогенность A.pleuropneumoniae, патогенез/клиническое проявление болезни обуславливают структурные клеточные элементы и белки, которые также используются при диагностике и иммунопрофилактике заболевания. Одним из наиболее изученных внеклеточных продуктов являются цитолизины (токсины) ApxI, ApxII, и ApxIII. Эти токсины являются важнейшим фактором патогенности A. pleuropneumoniae, обуславливая патологические процессы, наблюдаемые в организме животных (свиней). Токсин Apx IV экспрессируется в процессе инфицирования животных и хотя не вызывает патологических изменений, используется для диагностики болезни (Таблица 2).
Таблица 2. Зависимость выделения APX-токсинов от серотипа A. pleuropneumoniae
Особенности эпизоотологии
- Инфекция широко распространена во всем мире. В РФ инфекция выявлена в 82% обследованных хозяйств.
- Высока вероятность одновременной циркуляции нескольких серотипов в одном хозяйстве. Возможно наличие различных серотипов возбудителя на разных фермах одного и того же предприятия. Один или несколько серотипов являются доминирующими и легче всего идентифицируются при проведении лабораторных исследований. Однако, наряду с выявляемыми (доминирующими) популяциями микроорганизма, в биоценозе хозяйства возможно присутствие других серовариантов, остающихся не диагностированными. Проведение вакцинации свинопоголовья исключительно против выявленных серотипов (например, 2 и 6) приводит к защите стада от них, но освобождает экологическую нишу для других присутствовавших, но ранее подавляемых серотипов возбудителя (к примеру, 9).
- Источник возбудителя: больные и латентно инфицированные свиньи (бессимптомное носительство в миндалинах).
- Механизм/пути передачи: через объекты внешней среды, контактно, аэрогенно (до 800 м).
- Устойчивость микроорганизма: слабая (до 30 суток, при 4оС)
- ФАКТОРЫ риска (отягчающие патологический процесс):
- Иммуносупрессия (микотоксикозы, сопутствующие инфекции: РРСС, ЦВС2)
- Ввод в стадо животных-переносчиков (новые серотипы)
- Повышенная плотность посадки
- Недостаточная вентиляция
- Перепады температур
- Высокая влажность
Клинические проявления
Значительно варьируют в зависимости от серотипа возбудителя, условий содержания/кормления, иммунного статуса животных и др. Инкубационный период: от нескольких часов до нескольких дней.
ПАТОГЕНЕЗ:
- Адгезия (прилипание) A. pleuropneumoniae к поверхности легочного эпителия и миндалин
- Продуцирование APX токсинов (I-III)
- Разрушение: макрофагов, эпителиальных клеток, эндотелия сосудов
- Изменения в легочной ткани: ч/з 3 ч после инфицирования
- Воспаление (кашель, t до 42оС)
В зависимости от течения инфекционного процесса (острое, подострое, хроническое) в дальнейшем могут развиваться:
- токсико-септический шок и гибель животного
- геморрагически-некротическая пневмония и плеврит
- латентная инфекция и носительство возбудителя
ИММУННЫЙ ОТВЕТ:
при благоприятном развитии инфекционного процесса иммунная система животного вырабатывает специфические антитела, обеспечивающие защиту от токсинов и других факторов патогенности.
- Первичный ответ: 8-14 суток после инфицирования
- Максимальный уровень: 4-6 недель после инфицирования
- Циркуляция: несколько месяцев
Диагностика
Диагноз ставится комплексно, на основании совокупности эпизоотологических и патологоанатомических данных, клинических признаков, а также результатов лабораторных исследований (серологических, бактериологических или молекулярно-биологических). В зависимости от используемого метода, производится отбор различных биологических образцов (сыворотка крови, кусочки пораженной легочной ткани, бронхиальные и средостенные лимфатические узлы).
Отбор образцов для лабораторных исследований, его доставка и интерпретация результатов являются важнейшими мероприятиями, ошибки при проведении которых приводят к искажению и получению недостоверных сведений о ситуации в хозяйстве!
Для серологической диагностики данной инфекции широко используется выявление специфических антител против капсульных и клеточных антигенов.
Однако необходимо отметить, что защита животных от Actinobacillus pleuropneumoniae обеспечивается не только гуморальной, но и клеточной составляющей иммунной системы. Поэтому использование серологической диагностики для подтверждения иммунного статуса вакцинированного стада должно применяться с определенной осторожностью. И хотя разнородность титров специфических антител у животных одинакового возраста может косвенно указывать на неоднородность иммунитета, важнейшими показателями эффективности профилактики были и остаются:
- заболеваемость/клиническое состояние животных
- сохранность по технологической группе
- отсутствие характерных для АПП патологических изменений в легких вакцинированных животных (плевритов в дорсо-каудальных долях), выявляемых при постубойном обследовании животных и оцениваемых по методике SPES (Системе оценки плевритов на убойном пункте).
Характерные патологоанатомические изменения при различном течении болезни представлены ниже (Фото 1, 2, 3, 4).
Фото 1. Легкое свиньи группы откорма (110 д.ж.) с очагами геморрагически-некротической пневмонии в каудо-дорсальных областях.
Фото 2. Очаги геморрагически-некротической пневмонии в каудо-дорсальных областях (поперечный разрез).
Фото 3. Участок легкого с плевритом от вынужденно убитой свиньи группы откорма (120 д.ж.).
Фото 4. Сращение висцеральной и костальной плевры. Павшее животное (~150 д.ж.).
Важнейшим элементом диагностики и контроля данной инфекции является проведение регулярного мониторинга группы убойных животных (180-215 д.ж.) по методике SPES – системе оценки плевритов на убойном пункте (от англ. the Slaughterhouse Pleurisy Evaluation System). Поскольку хронические поражения плевры, присутствующие на момент убоя, легко выявляются и служат источником информации о состоянии и здоровье животных на ферме, проведение подобного исследования дает возможность своевременного контроля инфекции и/или оценки результативности проведенных ветеринарно-профилактических мероприятий. Специализированная система SPES, облегчает оценку плевральных поражений с учетом их расположения, проявления и интенсивности. SPES метод основан на системе баллов от 0 до 4, отражающих наличие, интенсивность и местоположение плевритов, наблюдаемых в обоих легких каждого животного непосредственно на убойной линии. Таким образом, подобное исследование позволяет оценить степень распространенности и тяжесть хронических поражений (плевритов, локализованных в дорсо-каудальной области легких), связанных с инфицированием микроорганизмом Actinobacillus pleuropneumoniae (A.p.).
Мероприятия
Подавляющая часть свиноводческих предприятий знакома с проблемой актинобациллезной плевропневмонии свиней не первый год, однако ранее наиболее эффективным решением являлась антибиотикотерапия. Высокую эффективность против данного микроорганизма показывают антибиотики пенициллинового и тетрациклинового ряда (например, Ветримоксин®L.A., Ветримоксин® 50%, Тетравет®L.A.), а также комбинированные формы (напримерТИАКЛОР®).
К сожалению, широкое и зачастую неграмотное применение антибактериальных препаратов (особенно низкокачественных субстанций) вызвали появление и распространение антибиотико-резистентных форм микроорганизмов и сделали процесс эффективного контроля АПП при помощи антибиотиков дорогостоящим и трудоемким. Поэтому в последнее время ветеринарные специалисты свиноводческих хозяйств все большее внимание уделяют именно вакцинопрофилактике бактериальных болезней.
В настоящее время на рынке РФ присутствует ряд коммерческих вакцин, направленных на профилактику всего комплекса болезней респираторной системы свиней и непосредственно актинобациллезной плевропневмонии свиней. Все вакцины являются инактивированными, однако по составу их можно разделить на две основных группы: бактериальные и бактерин-токсоидные (субъединичные). К последним относится современная комбинированная вакцина КОГЛАПИКС® от компании Ceva, в своем составе имеющая не только поверхностные антигены капсулы и стенки бактериальной клетки Actinobacillus pleuropneumoniae, но также токсоиды (анатоксины) – которые способствуют защите животного от непосредственного воздействия важнейших факторов патогенности — токсинов (APX I-III).
До 2010 года из всех предприятий, столкнувшихся с проблемой актинобациллезной плевропнемонии свиней, лишь около 23% применяло вакцины против АПП в комплексе мер по профилактике данной болезни. Это было обусловлено сложностью определения серотипов Actinobacillus pleuropneumoniae, циркулирующих на фермах предприятия, необходимостью постоянного мониторинга эпизоотической ситуации и корректировкой антигенного состава вакцины.
В середине 2010 года на рынке РФ появилась современная бактерин-токсоидная вакцина против АПП, обеспечивающая защиту свиней от всех возможных серотипов Actinobacillus pleuropneumoniaeи не требующая определения серотипа микроорганизма, присутствующего в хозяйстве. Появление такой вакцины значительно увеличило количество свиноводческих предприятий, желающих воспользоваться подобным инструментом для борьбы с актинобациллезной плевропневмонией.
Связанные темы: гемофилезная плевропневмония Актинобациллезная актинобациллярная гемофилезная плевропневмония ApxI ApxII ApxIII Apx IV Actinobacillus pleuropneumoniae SPES ветримоксин тетравет тиаклор коглапикс
Оценка легких убойных свиней, M. hyopneumoniae, АПП
Значительной информативностью для большинства респираторных заболеваний, особенно для энзоотической пневмонии и АПП, обладает оценка легких убойных свиней.
Безусловно, нужно помнить, что для постановки диагноза «энзоотическая пневмония» или «АПП» обязательны три составляющие:
- клиническая картина заболевания (для M. hyo это сухой непродуктивный кашель, напоминающий лай);
- положительные лабораторные исследования (серология, ПЦР или микробиология);
- характерные поражения легких на убое (рис. 1).
В отношении серологических исследований следует учитывать, что Mycoplasma hyopneumoniae — слабый индуктор гуморальных антител (IgG), выявляемых в коммерческих наборах ИФА. Серологические методы пригодны лишь для определения статуса стада (позитивное/негативное) и вероятного возраста инфицирования животных полевым возбудителем. Серология M. hyo не имеет никакой корреляции с поствакцинальной защитой. Более того, большинство вакцинированных против энзоотической пневмонии свиней остаются серонегативными в традиционных ИФА-тестах или демонстрируют низкие титры гуморальных антител.
Рис. 1. Здоровые (слева) и пораженные Mycoplasma hyopneumoniae (справа) легкие свиньи
Все методики оценки легких построены на том принципе, что общая поверхность легких составляет 100 % и каждая из семи долей легкого свиньи занимает определенную часть в этом целом. При осмотре учитывают степень поражения каждой доли отдельно и фиксируют для дальнейших расчетов. Регулярная оценка легких убойных свиней позволяет отслеживать в динамике такие важные показатели, как:
- число легких с пневмонией по группе убоя;
- число легких с плевритами и абсцессами по группе убоя;
- средний процент поражения поверхности легких по группе убоя;
- средний процент поражения поверхности легких среди свиней с пневмонией;
- число легких со значимым уровнем поражений (≥5 % поверхности легких).
Такую оценку рекомендуется проводить как минимум три-четыре раза в год, оптимально — ежемесячно. Полученные данные позволяют реально оценить степень давления возбудителя на стадо и экономический ущерб от заболевания. После вакцинации это исследование наглядно показывает степень «прогресса в защите легких» (у вакцинированных свиней уровень поражений должен быть ниже, чем у непривитых). В табл. 7 представлен пример применения метода оценки легких по системе PigMon в крупном российском холдинге.
Таблица 7. Сравнение эффективности двух программ вакцинации поросят против ЦВС-2, M. hyo и АПП методом оценки легочных поражений
Кроме уровня поражения поверхности легких, важный диагностический критерий — число легких с плевритами и абсцессами. Но здесь нужно помнить, что этот показатель характеризует уровень давления не только возбудителя АПП, а всего респираторного комплекса. Плевриты и абсцессы могут быть обусловлены многими респираторными возбудителями (АПП, микоплазмы, болезнь Глессера, стрептококки и др.).
Таким образом, всесторонний анализ результатов оценки легких и производственных данных позволяет реально оценить эффективность применяемых схем вакцинации на уровне стада.
Плевропневмония свиней — опыт борьбы с заболеванием
Доктор ветеринарных наук Мариан Поровски
ООО «Vet-Com» Ольштын
Частная ветеринарная практика «Animal» — Победиска
Плевропневмония — наносит значительные экономические потери мировому свиноводству. Возбудитель болезни — Actinobacillus pleuropneumoniae (App). Заболевание часто проявляется сверхостро и падеж может начаться буквально через несколько часов после полного благополучия стада. Плевропневмония может протекать и в хронической форме со стертыми и неоднозначными симптомами, нанося значительные производственные потери. При послеубойной экспертизе, как правило, наблюдаются спайки, плеврит и абсцессы в легких. Субклиническое течение актинобацилярной плевропневмонии (App) часто отмечается в стадах с замкнутым циклом, в которых могут встречаться животные, заражённые серотипами с низкой патогенностью и высоковирулентными штаммами. В таких случаях, могут происходить внезапные вспышки заболевания, в том числе связанные с другими коинфекциями. Подобные ситуации часто являются результатом ошибок в управлении стадом.
Раннее выявление и идентификация стад с субклиническим течением актинобацилярной плевропневмонии очень важно для успешной борьбы с заболеванием, потому что инфицированные животные (источники инфекции), являются и основными переносчиками заболевания между стадами.
Актинобацилярная плевропневмония представляет серьезную проблему для свиноводства в странах Латинской Америки, Азии, Европы. В Северной Америке основные меры направлены, в первую очередь, на выявление субклинических форм болезни в племенных стадах. Это необходимо для достижения племенными стадами статуса свободных от всех серотипов Actinobacillus pleuropneumoniae.
Стандартизация процедур и процессов, наряду с внедрением новых диагностических методов, оказало огромное влияние на выявление, контроль и последующую ликвидацию субклинической инфекции Арр. Тем не менее, периодически появляются ситуации, в которых даже опытным врачам трудно принять оптимальные решения, касающиеся Арр на обслуживаемых ими родительских и племенных фермах.
Арр можно классифицировать на основании параметров роста возбудителя in vitro, а также зависимости роста от фактора НАД (никотинамид динуклеотид), биотип I НАД-зависимый, биотип II НАД-независимый. В настоящее время идентифицировано 15 серотипов Арр (по различию полисахаридов клеточной стенки), из них, серотипы 1-12 относят к Арр биотипа II, серотипы 13 и 14 рассматриваются, как атипичный биотип II. Вместе с тем, некоторые европейские штаммы серотипов 2, 4, 7 и 9 могут также классифицироваться как атипичный биотип II, а североамериканские изоляты серотипа 13 – как биотип I. Некоторые серотипы имеют общие антигены (на уровне ЛПС), которые используются в настоящее время в серологических тестах и относятся к серологическим группам: серотипы 1, 9 и 11; серотипы 3, 6, 8 и 15; и серотипы 4 и 7.
Серотипирование App является предметом постоянных научных исследований, так как отдельные серотипы и входящие в них штаммы отличаются по вирулентности. А эта особенность, в свою очередь, зависит от географического происхождения. Перекрестные реакции при проведении серологических анализов часто затрудняют идентификацию некоторых изолятов. Решение этого вопроса лежит в разработке и постепенном внедрении молекулярной диагностики – главным образом ПЦР.
Серологический мониторинг, задачей которого является раннее обнаружение инфицированных животных с субклинической инфекцией на промышленных фермах, должен ориентироваться на наиболее часто встречающиеся в данном регионе серотипы App. Вакцины из целых бактериальных клеток (бактерины – коммерческие или аутовакцины) обеспечивают серотипичную специфическую защиту. Их применение должно обосновываться данными о серотипах, изолированных от больных животных или результатами точных идентификаций наиболее вирулентных серотипов в определенном регионе. Необходимо учитывать, что серотипы Арр, которые наиболее часто выявляются в серологических тестах у животных-носителей, часто отличаются от тех, что выделяют от больных животных. Это относится к серотипам 6, 8, 12 и 15, характеризующимся высокой степенью распространения при отсутствии клинических симптомов, и поэтому наиболее легко обнаруживаются в серологических тестах.
В Польше серотипы 2, 4, 6, 7, 9 квалифицируются как высоко вирулентные и в большинстве клинических случаев являются этиологическим фактором заболевания. Вместе с тем, изоляты одного серотипа могут отличаться вирулентностью в зависимости от географического происхождения. У экспериментально зараженных животных французскими штаммами App серотипа 2 клинические симптомы проявлялись уже через несколько часов после заражения, и отмечалась очень высокая смертность. У животных, зараженных канадскими штаммами одного серотипа, клинических симптомов и даже подъема температуры, не отмечалось. Существует четкое различие между двумя группами штаммов серотипа 2. Так, европейские штаммы продуцируют токсины Apx II и Apx III, а канадские (и американские) – только Apx II. Тем не менее, до конца не известно, объясняет ли это существенную разницу в вирулентности. Плевропневмония свиней остается не до конца изученным заболеванием. Трудно предугадать появление клинических симптомов в субклинически зараженных стадах. Изоляция штамма вирулентного серотипа у клинически здорового животного (носителя) еще не означает, что он лишен вирулентности.
Пути распространения заболевания.
Заболевание распространяется аэрогенным путем от свиньи к свинье, свиньи являются и основным естественным резервуаром инфекции. Другие виды животных, крупный рогатый скот, овцы могут быть случайными носителями Арр, но они не играют существенной роли в распространении этого микроорганизма. Очень вероятно, что определенную роль в распространении Арр может играть человек и мелкие грызуны и птицы. Снижение иммунитета животных, связанное с вирусными или бактериальными инфекциями, в том числе, в первую очередь, с Mycoplasma hyopnumoniae и цирковирусом свиней (ПЦВ-2), может способствовать быстрому распространению Арр. Довольно часто вспышка плевропневмонии на фоне заражения стада вирусом РРСС. Как показывают эпизоотические данные, хряки бывают вектором переноса инфекции между стадами.
Значительную роль в распространении плевропневмонии играют предрасполагающие факторы. Среди них решающее значение имеют: чрезмерная плотность животных и плохой микроклимат (повышенная влажность, высокая концентрация аммиака и запыленность). Поэтому, не удивительно, что Арр возникает в основном осенью и весной. Уровень заболеваемости и падежа животных зависят от вирулентности штамма App и наличия факторов риска. В случае инфицирования благополучного стада, болезнь, как правило, имеет очень тяжелое течение. Заболевание может проявиться во всех группах свиней, но наибольшую угрозу оно представляет для подсвинков и свиней на откорме.
В эндемически зараженных свинарниках, с чем чаще приходится сталкиваться, хроническая форма Арр, несмотря на то, что она часто остается не заметной с клинической точки зрения, приносит очень серьезные экономические потери. Только при послеубойной экспертизе можно наблюдать патологические изменения органов дыхания. Во время клинической фазы App проявляется, в основном, в некротических изменениях в легких и/или в миндалинах, реже в полости носа. Поэтому инфекция передается воздушно-капельным путем от одной свиньи к другой. Микроорганизм сохраняет жизнеспособность в выделениях и других биологических жидкостях до 5 дней, в воде может выживать в течение 20 дней и даже дольше, но чувствителен к высушиванию. Аэрогенным путем бактерия переносится, вероятно, только на расстояние 5-10 метров. Течение заболевания зависит от заражающей дозы и патогенности микроорганизма, т. е. чем больше бактерий попадает в организм животного, тем тяжелее протекает заболевание.
Патогенез
Плевропневмония свиней, вызываемая Actinobacillus pleuropneumoniae, все еще недостаточно изученное заболевание. Результаты многочисленных исследований in vitro показывают, что цитотоксины (гемолизины и цитолизины) Actinobacillus pleuropneumoniae (App) убивают альвеолярные макрофаги (англ. AM, alveolar macrophages). Важнейшую роль в патогенезе плевропневмонии играют гемолизины Apx I, Apx II и Apx III, характеризующиеся цитотоксическим и антифагоцитарным действием на альвеолярные макрофаги легких. Альвеолярные макрофаги играют основную роль в первой линии защиты дыхательных путей от микроорганизмов и они очень чувствительны к действию цитотоксина App, in vitro даже очень низкие концентрации цитотоксина в течение короткого времени вызывают серьезные и необратимые изменения, а высокие концентрации вызывают их гибель. Исследования in vitro показали, что клетки App, попавшие в альвеолярные макрофаги, не погибают, а размножаются и разрушают их. App оказывает цитотоксическое влияние на альвеолярные макрофаги даже в присутствии сыворотки крови свиней экспериментально зараженных – тем же штаммом Арр. Фагоциты, защищенные антителами, только частично убивали фагоцитированные Арр, так как эти бактерии производят цитотоксины и внутриклеточно.
По данным последних исследований in vitro предполагается, что при заражении Арр происходит множество разнообразных реакций: клетки App проникают в дыхательные пути, несмотря на защиту со стороны реснитчатого эпителия, попадают в альвеолярное пространство, где фагоцитируются альвеолярными макрофагами и с ними проникают в легочную ткань. Арр выживают и размножаются в альвеолярных макрофагах. Гибель инфицированных альвеолярных макрофагов усугубляет воспалительную реакцию, в результате чего происходит приток многоядерных нейтрофилов (МН). Клетки Арр не проходят через бронхиальные лимфатические узлы, это указывает на активную роль многоядерных нейтрофилов в предотвращении бактериального сепсиса. В результате цитотоксического действия App происходят некротические и геморрагические изменения в пределах легочной ткани.
Клинические симптомы.
В зависимости от иммунного статуса животных, условий окружающей среды и интенсивности инфекции различают клиническое течение заболевания может резко отличаться, от очень острого (падеж через несколько часов после обнаружения первых симптомов) до, в принципе, бессимптомного.
Острая форма заболевания обычно встречается в стадах, в которых возбудитель App попадает впервые (полностью чувствительные стада). Смерть свиней наступает в течение нескольких или нескольких десятков часов после заражения. К характерным для этой формы клиническим симптомам относятся: резкое повышение внутренней температуры тела (в.т.т.) до 41,5°С, цианоз и симптомы апатии. У больных, чаще всего лежащих на боку, изначально не наблюдается каких-либо явных симптомов со стороны дыхательной системы. Только незадолго до смерти становится заметным: значительное затруднение дыхания, пенисто-кровяные выделения из полости рта и/или носа, ускорение сердечного ритма и острая недостаточность кровообращения. Из-за этого, в частности, развивается цианоз носа, ушей, конечностей и, в конце, всей поверхности кожи. Воспаление легких при плевропневмонии характеризуется брюшным дыханием, вызванным болезненностью, связанной с плевритом.
Подострая или хроническая форма развиваются в течение нескольких недель после острых симптомов заболевания. Повышение в.т.т. может быть незначительным, а усиление и проявления кашля разнообразным. Хронический кашель и задержка роста обусловлены наличием спаек в плевре и абсцессов, которые образуются в восстанавливающийся легочной ткани. Животные демонстрируют переменный аппетит, снижаются привесы.
В стадах, эндемически зараженных App, у значительного процента животных отмечаются симптомы хронической плевропневмонии, которая может обостряться при возникновении вирусных и бактериальных коинфекций.
Диагностика базируется на клинических симптомах, изменениях в легких и лабораторных тестах. Учитывая эпизоотическое значение заболевания, при каждом подозрительном случае, должно быть проведено бактериологическое исследование с изоляцией микроорганизма. Так как Actinobacillus pleuropneumoniae может долго выживать в тканях после смерти животного (до 5 дней), при острой форме заболевания, выделение патогена относительно просто. Существенным моментом в бактериологическом исследовании является применение селективных сред с добавлением DPN или НАД.
При хроническом течении плевропневмонии, бактериологическая диагностика более сложная и трудно получить изолят Арр. Поэтому, целесообразно использовать, например, методы ИФА со специфическими антителами.
Бактериологическое выделение App в стадах, в которых нет клинических симптомов плевропневмонии, крайне сложно. Также нелегко обнаружить Арр у так называемых, клинически здоровых носителей, у которых, как правило, они находятся в миндалинах и реже в полости носа. Для этого обычно используют метод прижизненного соскоба (мазка) с миндалин.
Серологические исследования в настоящее время наиболее выгодный в экономическом плане метод диагностики Арр, позволяющий выявить стада с субклиническим заболеванием. Раньше применяли метод связывания комплемента, но из-за его низкой чувствительности и специфичности от него отказались. В большинстве стран в настоящее время широко используется ИФА. Выделяется две группы тестов ИФА: с использованием серотипо/серогруппо-специфических липополисахаридов (LPS), что позволяет обнаруживать все серотипы Арр (без их дифференциации) и с использованием токсина Apx IV. Самым популярным является анализ LPS-ИФА, позволяющий определять титры антител против определенных серотипов или серогрупп App: 1/9/11; 2, 3/6/8/15; 4/7; 5, 10, 12, 13 и 14. Он широко применяется в Северной Америке, Дании и Франции. На рынке существуют, по крайней мере, два коммерческих набора Apx IV. На данный момент доступна коммерческая версия такого набора. Предполагается, что животные с субклиническим течением Арр (без клинических симптомов) могут давать низкие титры антител именно против токсинов. Этот анализ характеризуется относительно низкой чувствительностью, в то же время иммунофлюоресценция с использованием технологии «микросфер» с таким же антигеном, имеет значительно более высокую чувствительность.
ИФА с антигенами LPS и ApxIV, определяющий антитела к определенным серотипам/серогруппам и всех серотипов App, очень полезен, при правильном примени и интерпретации результатов. Несмотря на то, что периодически сообщается о ложно-положительных результатах в стадах с высоким статусом здоровья, свободных от Арр, ИФА с Apx IV можно использовать для мониторинга. Несмотря на то, что этот тест обладает более низкой чувствительностью, чем LPS-ИФА он позволяет обнаружить сероконверсию даже в иммунодефицитном стаде.
Недавно был разработан иммунофлуориметрический анализ (ИФМА) типа мультиплекс с использованием микросфер, позволяющий выявить и идентифицировать все серотипов Арр. На практике он может оказаться очень значимым инструментом диагностики, но нуждается в дальнейших исследованиях и полной проверке.
Лечение и профилактика
Когда инфекция на ферме протекает без клинических симптомов, сложно определить этиологический фактор. Используемые программы контроля должны учитывать эпидемиологическую специфичность Арр. Абсолютным приоритетом является контроль и анализ экономических потерь: смертность животных, клиническая и субклиническая форма заболевания. Очень важной процедурой в диагностике хронической и субклинической формы Арр является послеубойная экспертиза, позволяющая оценить возможности контроля инфекции. Смертность можно уменьшить лечением случаев заболеваний и целых инфицированных групп антибактериальными препаратами. Заболевание нужно лечить уже на ранней стадии. Обязательным условием является введение новых групп животных в помещения с чистым микроклиматом и содержание их в изоляции от остальных животных. Необходим постоянный, систематический контроль всех факторов окружающей среды (температура, вентиляция, влажность и т. д.). Определенного рода решением является установка перегородок между клетками, чтобы свести до минимума возможности распространения и обострения заболевания. Для уменьшения риска заражения следует придерживаться принципа «пусто – занято», проводить ранний отбор и отъем больных и подозрительных животных. В стадо следует вводить животных исключительно из стад с известным статусом по App, чтобы избежать заноса новых серотипов. В стадах с хронической и субклинической формой Арр, перед вводом в стадо новых серонегативных свиней следует провести их вакцинацию.
Специфическая профилактика
Хорошие результаты в профилактике плевропневмонии дает применение коммерческих гомологичных вакцин или аутовакцин (бактерин), то есть таких, в составе которых находится серотип или серотипы, являющихся причиной заболевания свиней в стаде. Примером коммерческой вакцины на внутреннем рынке является «Аптовак», которая содержит в своем составе серотипы App, наиболее часто изолируемые в Польше (серотипы 2, 6 и 9). Всегда перед введением такой вакцины целесообразно провести бактериологические или серологические исследования для определения циркулирующих серотипов.
Вакцинация с использованием серотипоспецифичных аутовакцин создает и определенный перекрестный иммунитет с другими серотипами, хотя до сих пор это четко не доказано. У животных, вакцинированных бактеринами, вырабатываются антитела, перекрестно реагирующие в тестах ИФА с использованием полисахаридов, как антигенов. Субъединичные вакцины в состав, которых входят три основных экзотоксина RTX (ApxI, ApxII и ApxIII) с дополнительным белком 42 кДа внешней клеточной мембраны A. pleuropneumoniae или без них, обеспечивали высокую защиту от всех серотипов (1-15), как в экспериментальных условиях, так и в полевых исследованиях. Уже доступны комплексные вакцины – токсин-бактерин. Продолжаются исследования по повышению эффективности вакцин. В США зарегистрирована живая вакцина, в которой использовалась штамм Арр с мутацией, блокирующей образование капсулы.
Вакцины защищают от заболевания, значительно снижают смертность животных, а также уменьшают число циклов лечения, позволяют повысить суточные привесы и кормоконверсию. Решению о начале вакцинации в стаде должен предшествовать тщательный анализ. Как правило, рекомендуется вакцинировать поросят, но первую дозу не следует давать ранее, чем на 8 неделю жизни, чтобы избежать интерференции с материнскими антителами. Вторая доза вакцины дается через 4 недели, чтобы получить эффект супер иммунизации. Программа вакцинации может также распространяться и на основное стадо (свиноматки, хряки, свинки), но следует помнить, что при применении субъединичной вакцины, свиноматки передают с молозивом антитела только против токсинов. Поэтому такие вакцины не защищают поросят от раннего заражения A. pleuropneumoniae.Для защиты необходимо применять вакцины с инактивированными клетками A. pleuropneumoniae соответствующего серотипа.
Терапия
В лечении плевропневмонии важную роль играют альвеолярные макрофаги и МН (многоядерные клетки), насыщенные антибактериальными средствами, которые защищают их от проникновения бактерий. Опыт в этой области показывает, что антибактериальные вещества, которые проникают в клетки и накапливаются там, представляют собой эффективный метод лечения A. pleuropneumoniae.
Считается, что препаратом первого выбора должен быть тот, который обладает самой низкой минимальной ингибирующей концентрацией (МИК). Следует, однако, учитывать также фармакокинетические свойства выбранного антибиотика. Было доказано, что различные антибиотики с минимальным значением МИК в своей категории значительно различаются потенциалом контролирования острой инфекции. К наиболее часто используемым антибиотикам относят Энрофлоксацин, Марбофлоксацин, Флорфеникол, Тилмикозин, Амоксициллин, Цефтиофур, Тулатромицин, Триметоприм/Сульфатриметоприм, Тиамулин, Хлортетрациклин, Доксициклин. Безусловно, можно использовать и другие антибиотики. В полевых условиях удовлетворительные результаты получали при применении Марбофлоксацина, Энрофлоксацина, Флорфеникола, Тилкомизина и Тулатромицина, но основанием для выбора антибиотика должно быть выделение возбудителя и определение его антибиотикочувствительности.
В последнее время очень эффективным антибиотиком в разных концентрациях для лечения инфекции A. pleuropneumoniae оказался Марбофлоксацин. Марбофлоксацин 16 % применяется в дозе 8 мг/1 кг м. т., это фторхинолоны третьего поколения, обладающие удлиненным периодом полувыведения (около 16 ч) и очень хорошей биодоступностью (93%). Дополнительной особенностью этого антибиотика является очень хорошее распределение в тканях, в том числе в миндалинах, которые являются основным резервуаром A. pleuropneumoniae. Концентрация 16% Марбофлоксацина в миндалинах оказывается выше, чем в плазме крови, и в сотни раз превышает средние концентрации МИК для App. Низкая степень связывания с белками плазмы <10%, большая доступность свободной фракции, вызывает очень быстрое достижение максимальной концентрации препарата в плазме крови (около 55 минут). Эта особенность имеет большое значение для достижения оптимального терапевтического эффекта, что особенно важно при остром течении болезни с быстрым развитием некротических и геморрагических изменениях в легких после заражения.
Соответствующий фармакокинетический профиль in vivo 16% Марбофлоксацин в дозе 8 мг/1 кг массы тела (продолжительность периода, когда концентрация антибиотика выше уровня, предотвращающего мутации и возникновение резистентности) снижает риск возникновения резитентности. Высокая концентрация в сыворотке крови, быстрый бактерицидный эффект в течение 1-3 часов, полученный in vitro, а также очень хорошее проникновение в ткани предрасполагает к выбору этого антибиотика для лечения в виде однократной инъекции (SISAAB). Дополнительной особенностью этого антибиотика из-за фармакокинетических свойств является его продолжительное и эффективное действие (до 36 ч).
Антибиотикотерапия эффективна у животных с клинической формой заражения только в начальной стадии заболевания, когда она может уменьшить смертность. Вместе с тем высокая эффективность антибиотикотерапии может влиять на иммунный ответ у животных. Очень эффективные антибиотики, убивая возбудителя, снижают выработку антител и в последующем леченные животные остаются восприимчивыми к реинфекции. С другой стороны, задержка с началом лечения может привести к таким повреждениям с которыми, даже если животное выздоровеет, дыхательная система будет функционировать с нарушениями.
Антибиотики следует вводить парентерально (подкожно или внутримышечно) в высоких дозах. Для обеспечения эффективной и длительной терапевтической концентрации препарата в крови для некоторых антибиотиков могут потребоваться многократные инъекции, в зависимости от фармакокинетических характеристик применяемого препарата. Успех лечения зависит, прежде всего, от раннего выявления клинических симптомов и быстрого начала лечения. Терапия плевропневмонии с дачей препаратов с водой или кормом может использоваться только программах профилактики, так как при острой инфекции этот способ лечения недостаточно эффективен, поскольку у больных животных плохой аппетит и нет жажды. Кроме того, при заболевании возникают очень интенсивные общие симптомы, вызванные продукцией циклооксигеназы 2, который отвечающей за запуск воспалительных реакций в организме.
Дача лекарств с кормом или водой может быть формой стратегической антибиотикотерапии по предотвращению острых вспышек заболевания в сильно инфицированных стадах. Можно выбрать постоянное или импульсное лечение, но ни одно из них не должно длиться слишком долго, и, кроме того, следует постоянно контролировать антибиотикочувствительность возбудителя. Несмотря на то, что лечение кажется клинически эффективным, следует иметь в виду, что антибиотикотерапия не уничтожает инфекцию в стаде. Очаги хронической инфекции в легочных абсцессах или на миндалинах животных-носителей сохраняются, являясь важным источником инфекции для других животных. Результаты, полученные до сих пор, различными группами исследователей указывают на то, что антибиотикотерапия не позволяет полностью ликвидировать бактерии у животных-носителей.
Программы эрадикационной терапии
Попытки эрадикации (оздоровления) инфекции A. pleuropneumoniae касаются, прежде всего, племенных стад, которые должны быть свободны от нее. Условием начала программы элиминации патогена с фермы является выполнение ряда мер. Основное условие — отсутствие острой формы заболевания на ферме в течение, по крайней мере, 6 месяцев и годовая иммунизирования стада субъединичной вакциной или вакциной, содержащей бактериальный антиген. Также необходимо раннее выделение и определение серотипа штамма и его антибиотикочувствительности. После выполнения этих условий необходимо провести частичную депопуляцию стада (удаление подозрительных в инфицировании), оставляя на ферме свиноматок и свинок основного стада. Если на ферме есть хряки, с ними следует проделать те же процедуры. В подготовленном таким образом стаде можно начать эрадикационную терапию с использованием антибиотика в соответствии с результатами полученных исследований. В Европе самый большой опыт программ эрадикационной терапии App имеют врачи из Дании. Самые эффективные антибиотиками в эрадикационной терапии этого заболевания оказались: Марбофлоксацин и Энрофлоксацин, это подтверждают также собственные наблюдения. В США программы эрадикационной терапии основаны на аналогичных принципах, только с тем, что в секторе опороса остаются поросята. Их очень рано отнимают (на 17-18 день) и подвергают интенсивной антибиотикотерапии. Свиноматки в период за 14 дней до опороса и в период лактации получают корм с подобранным антибиотиком. Поросят-отъемышей перевозят от матерей на другие фермы, где доращиваются свинки, признанные свободными от App. Основанием для оценки эффективности программы эрадикационной терапии Арр является введение в такое стадо свинок «sentinels» из стада, свободного от App. Таким свинкам делают циклические серологические анализы. Отрицательные результаты в течение последующих 2 лет, указывают на успех проведенной эрадикационной терапии. Кроме того, производится диагностический убой нескольких свиноматок, участвующих в программе элиминации патогена на ферме. Такой убой должен проводиться за пределами бойни, чтобы избежать возможного загрязнения. От убитых свиноматок берутся миндалины, и проводится исследование в ПЦР на ДНК A. pleuropneumoniae. Отрицательный результат в ПЦР подтверждает успех проведенной программы элиминации патогена на ферме. Также можно сделать анализ ПЦР соскоба с миндалин, однако достоверность результатов будет меньше, чем в случае исследования материала, полученного при диагностическом убое, так как A. pleuropneumoniae глубоко проникает в миндалины и при соскобе не всегда удается добраться до места обитания патогена.
В заключение стоит отметить, что проблемы, связанные с App, наблюдаются на протяжении более 50 лет. По-прежнему, мы не знаем ответы на все вопросы, касающиеся этой инфекции. У нас есть отличные инструменты для мониторинга и диагностики острых, хронических и субклинических случаев. Одновременно мы располагаем хорошими программами контроля и профилактики этого заболевания, но нельзя недооценивать плевропневмонию свиней, особенно связанную с хронической формой болезни.
Болезнь Ауески
Важное значение в респираторном комплексе занимает вирус болезни Ауески. По сложившемуся стереотипу, многие специалисты относят этот возбудитель к группе болезней, проявляющихся в нервной форме. Однако нервные явления можно наблюдать в основном только у поросят-сосунов, полученных от серонегативных свиноматок. С учетом того, что во многих хозяйствах России отмечается хроническая циркуляция полевого возбудителя и большинство свиноматок серопозитивные, данная форма болезни встречается довольно редко. У поросят групп доращивания и откорма вирус болезни Ауески вызывает респираторные нарушения и является составной частью КРБС. В системе профилактики и контроля этого заболевания вакцинация — основное звено. В большинстве стран с развитым свиноводством реализуются национальные программы по искоренению болезни Ауески с использованием только маркированных вакцин, особенно на эндемичных территориях. Главное преимущество таких вакцин в том, что после их применения легко провести дифференциацию поствакцинальных антител от постинфекционных. В нашей стране доступны как маркированные вакцины, так и дискриминирующие тесты. К сожалению, практически все российские вакцины немаркированные (gE+).
Интерпретация результатов серологических исследований проводится так:
- gB — общие антитела к вирусу болезни Ауески;
- gE — антитела к полевому или вакцинному немаркированному вирусу;
- gB+gE+: животные имеют антитела после контакта с полевым вирусом болезни Ауески и/или после вакцинации немаркированной вакциной (или колостральные антитела от таких матерей), если животные привиты маркированной вакциной и имели «приживление» полевого вируса, то все равно будут gB+gE+;
- gB+gE–: животные имеют антитела к вакцинному маркированному вирусу (или колостральный иммунитет от вакцинированных матерей, привитых маркированной вакциной), животные не имели контакта с полевым вирусом;
- gB–gE–: животные серонегативные по Ауески.
На рис. 2 представлен пример вакцинации маркированной вакциной в одном крупном российском холдинге.
Рис. 2. Оценка эффективности маркированной вакцины против болезни Ауески с использованием дискриминирующей диагностики (gB, gE) в позитивном хозяйстве
В проведенном нами исследовании привитые и невакцинированные свинки содержались вместе в одном помещении (секторе). Ремонтных свинок прививали маркированной вакциной Ингельвак Ауески MLV в 90 и 120 дней жизни. Сыворотки крови исследовали в наборах ИФА IDEXX на наличие антител к белкам gB и gE. Как видно из результатов исследований, к 170-му дню жизни все непривитые животные были позитивны к полевому вирусу (gЕ+). Среди вакцинированных все были позитивны к Ауески (gB), но только 10 % животных имели антитела к полевому вирусу (gE), что свидетельствует о хорошей защите привитых животных от полевого возбудителя.
Таким образом, при использовании маркированных вакцин и дискриминирующих тестов ИФА у нас появляются реальные инструменты контроля ситуации и оценки эффективности вакцинации против болезни Ауески.
Актинобациллярная плевропневмония
Актинобациллярная плевропневмония свиней (Pleuropneumonia suis) —
относительно новая болезнь, приводящая к большим экономическим потерям на средне- и крупно-товарных фермах. Болезнь часто протекает в острой форме у подсосных и поросят на откорме, а также у свиней основного стада. В последнее время она считается самой грозной бактериальной болезнью респираторной системы свиней. Из-за определенных трудностей при лабораторной диагностике даже при наличии клинических признаков бывает трудно получить бактериологическое подтверждение.
Этиология.
Плевропневмонию вызывает
Actino-bacillus pleuropneumoniae
(Арр). Различают 12 серотипов возбудителя. В Польше обнаружены серотипы Арр: 1, 2, 4, 5, 6 и 9, но превалируют 2, 4, 6 и 9. Вакцина из одного серотипа не защищает от других, но после естественного переболевания развивается перекрестный иммунитет. При острой форме болезни смертность может достигать 90%. Характерной чертой является внезапное появление у свиней острых признаков поражения респираторной системы и падеж.
Эпизоотологические данные.
В Польше плевропневмония встречалась повсеместно, особенно в районах с интенсивным свиноводством. В последнее время доказано, что плевропневмония проявляется, преимущественно, в стадах, зараженных вирусом
РРСС.
Подъем заболеваемости отмечается в осенне-зимний период. Развитию болезни благоприятствует влажность в помещениях, что часто связано с кормлением животных жидким кормом.
Патогенез.
Патогенез плевропневмонии определяют факторы, вирулентности
Арр –
гемолизины
Apxl, ApxII , Арх III,
внешние белки, липополисахариды и полисахариды клеточной стенки. Инфицированные свиньи могут выделять с истечениями из носа миллиарды клеток Арр. Через несколько часов после инфицирования животного микроб интенсивно размножается и распространяется, главным образом, по лимфатическим сосудам. Из трахеи микроорганизм можно выделить через 3-6 часов после инфицирования, а из легких — через 9 часов.
Клинические признаки.
Зависят от формы болезни, которая может быть сверхострой, острой, подострой и хронической. При сверхострой форме, проявляющейся внезапно у единичных животных, обнаруживается высокая температура тела (41,5°С) и очень тяжелое общее состояние, у некоторых особей наблюдаются кратковременная диарея и рвота. Животные лежат, апатичны, дышат ртом, из ноздрей и рта выделяется кровянистая пена, наблюдается сильный цианоз передней части рыла, ушных раковин, конечностей, а затем и кожи на всей поверхности тела. Смерть наступает в течение 3-24 часов. Молодые поросята иногда погибают от сепсиса без развития клинических признаков. При острой и подострой форме повышенная. температура тела (40,5-41°С) наблюдается у многих свиней в одном или нескольких станках. Заметно выражены признаки поражения легких (удушье, кашель, выделения из носа) и нарушения кровообращения (цианоз). Болезнь развивается в зависимости от размеров очагов воспаления в легких и резистентности животных, поэтому одновременно может встречаться тяжелое или более легкое течение. В последнем случае болезнетворный процесс теряет остроту и переходит в хроническую форму. При хронической форме температура чаще нормальная, отмечается периодический кашель, у многих особей вообще нет заметных признаков заболевания. При энзоотическом распространении болезнь чаще поражает 6-12-недельных поросят и проявляется постоянным кашлем. Симптомы могут усилиться при осложнении
Pasteurellamultocidaи/илиBordetellabronchiseptica.
Патологоанатомические изменения.
При сверхострой форме носовая полость и трахея заполнены кровянистой жидкостью. На слизистой трахеи и миндалин — пенисто-кровавый выпот, в легких — гиперемия и сильный отек, затрагивающий соединительную ткань. Отдельные участки легких сильно наполнены кровью, утолщены, с интенсивной темно-красной окраской и безвоздушной консистенцией. Как правило, отмечается фибринозный плеврит, плевра покрыта желтым или красноватым фибрином. Очаги воспаления рассеяны по всем легким, разной формы, выступают над поверхностью, чаще находятся в диафрагмальных, в передних и сердечных долях. На разрезе польки разделены утолщенной соединительной тканью и имеют хрупкую консистенцию (острая и подострая формы). Воспаление может переходить в некроз. При хронической форме встречаются бугорки разной формы, рассеянные по поверхности диафрагмальных долей. Они плотно окружены соединительной тканью и содержат гной. Фибринозный плеврит может сопровождаться срастанием легочной, реберной плевры и перикардиальной сумки. У переболевших свиней изменения в легких исчезают, но остается
ч
астичное сращение плевры.
Взятие и пересылка материала ля исследований.
Материал для лабораторных исследований должен быть свежим. Отбирают выделения из носа, трахеи, бронхов, кусочки измененной ткани на границе со здоровой. При сверхострой форме с сепсисом возбудитель может быть выделен из внутренних органов, но при других формах -только из поражений легких, бронхиальных лимфатических узлов или выделений из дыхательных путей. Обязательно устанавливают серотип
Арр.
Статус стада в целом определяют по результатам серологических исследований крови свиноматок и поросят на откорме.
Меры борьбы.
Вакцинопрофилактика эффективна только при использовании вакцин, изготовленных из серотипов возбудителя, вызывающего заболевание. Вакцина из серотипов
Арр.
Превалирующих в нашей стране (2,6), рекомендуется хтя вакцинации животных с 8-11 -недельного возраста. Вакцина вводится по 2 мл двукратно с промежутком 3 недели. Целесообразна ревакцинация через три месяца.
Аптовак
дает хороший результат при совпадении серотипов
Арр
на свиноферме и в вакцине. Поэтому перед вакцинацией необходимы бактериологические или серологические исследования для установления серотипов
Арр
на ферме.
Если серотипы Арр
не идентифицированы или их несколько (при поступлении животных из других стад), рекомендуется вакцина
PorcilisАрр
на основе белков внешней оболочки бактерий и трех гемолизинов (
Apxl, ApxII, АрхПГ).
Считается, что вакцина защищает от болезни, независимо от серотипа возбудителя. Поросят рекомендуется вакцинировать на 6 неделе жизни и ревакцинировать через 4 недели. В состав вакцины входят токсины
Арр.
поэтому довольно часто она вызывает общую реакцию у поросят. В западноевропейских странах, преимущественно в Дании, где болезнь обнаруживалась даже у 5-6-недельных поросят.
Porcilis Арр
применяется для вакцинации свиноматок. Поросята от свиноматок, иммунизированных за 8 и 2 недели до опороса, устойчивы к заражению
Арр
до 12-14 недели жизни. Для лечения используют: пенипиллины, цефаллоспорины, тетрациклины и тилмикозин
(Пулъмотил).
Чем раньше начато их применение, тем выше эффективность лечения. На первом этапе антибиотик вводят парентерально, причем животным с острой формой, инъекции повторяют через 24 часа. В последующие 3-5 дней рекомендуется дача лекарств с кормом. Необходимо лечить всю группу животных, а не только свиней с клиническими признаками. При оздоровлении стада, если процент серопозитивных особей невелик, освобождать ферму необходимо последовательно, удаляя положительных свиноматок, после отъема 3-недельных поросят, которые должны выращиваться в отдельных помещениях, без контакта со взрослыми свиньями. 12-недельные особи могут быть введены в стадо после удаления всех серопозитивных свиней, или даже раньше, если в корм добавляют антибиотики. Очень важную роль в борьбе с
Арр
при оздоровлении стад играет дезинфекция.